 400-780-8018
400-780-8018
抗体偶联药物(Antibody Drug Conjugate,ADC),是通过连接子(Linker)将单抗(Antibody)和毒性药物小分子(Payload)偶联而成,被称为肿瘤治疗领域的“生物导弹”。ADC兼具单抗类药物对肿瘤细胞的靶向性和细胞毒性药物的强大肿瘤杀伤力,且克服了单抗的细胞毒性弱和细胞毒性药物系统毒性大的问题是目前抗肿瘤药物研发的热点之一。
ADC 药物通过抑制肿瘤DNA复制或阻滞细胞周期诱导肿瘤细胞死亡。ADC药物进入血液循环后,与肿瘤细胞表面靶向抗原受体结合,形成ADC抗原复合物,被肿瘤细胞内吞,进而经过溶酶体降解,细胞毒素在胞内释放,结合至DNA小沟或微管蛋白,抑制肿瘤DNA复制或阻滞细胞周期,诱导肿瘤细胞死亡。疏水性小分子毒素还可以通过细胞膜扩散,对邻近肿瘤细胞产生杀伤活性,称为旁观者效应。
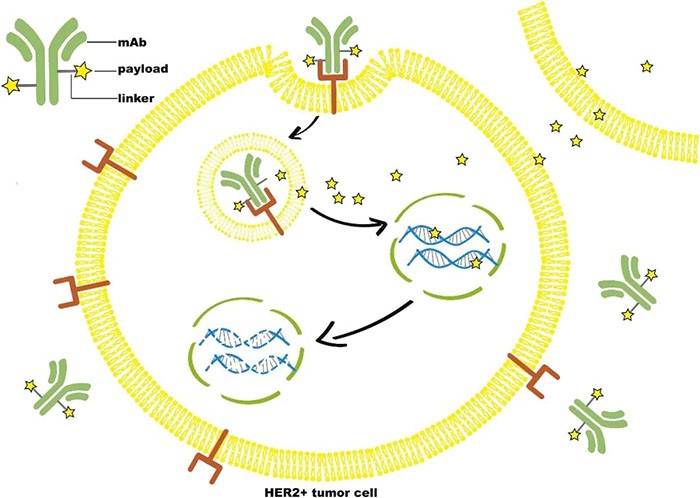
ADC药物的旁观者效应示意图[1]
ADC 药物通过抑制肿瘤DNA复制或阻滞细胞周期诱导肿瘤细胞死亡。ADC药物进入血液循环后,与肿瘤细胞表面靶向抗原受体结合,形成ADC抗原复合物,被肿瘤细胞内吞,进而经过溶酶体降解,细胞毒素在胞内释放,结合至DNA小沟或微管蛋白,抑制肿瘤DNA复制或阻滞细胞周期,诱导肿瘤细胞死亡。疏水性小分子毒素还可以通过细胞膜扩散,对邻近肿瘤细胞产生杀伤活性,称为旁观者效应。此外,ADC 还具备 ADCC(抗体依赖的细胞毒性作用)、CDC(补体依赖的细胞毒性作用)等抗体的免疫效应。
一个ADC药物的成功通常取决于以下几大要素的设计:
靶向抗原的选择是ADC药物设计的关键一环。需满足:
1、特异性,肿瘤细胞高表达、正常细胞低表达或不表达;由于靶点选择需要杀伤肿瘤细胞,因此抗原不应该存在于健康细胞上,因此靶点选择方面应特别注意特异性(如HER2)
2、靶向抗原需为肿瘤细胞表面抗原;
3、高效诱导内在化过程(internalization)等。
理论上ADC药物可在肿瘤细胞外释放毒素,不经过细胞内在化,通过“旁观者效应”对肿瘤细胞造成杀伤。但实际上目前大部分ADC药物疗效的实现均是以内在化后的药物释放为基础。因此,ADC药物中的抗体和肿瘤细胞表面抗原结合后,ADC-抗原复合物需能有效诱导内在化过程,进入肿瘤细胞内,并通过适当的细胞内转运和降解过程,实现小分子药物的有效释放。
基于抗体的药物出现使得癌症、自身免疫性疾病、心血管疾病、良性血液病和骨骼疾病等多种疾病的治疗取得了实质性进展。抗体片段和双特异性抗体为创新疗法提供了很有潜力的治疗前景。
抗体的选择是ADC设计的起点,连接子与偶联技术是决定药物稳定性及毒性副作用的关键因素。抗体选择方面,第二代与第三代药物由于在抗体方面使用人源单抗。人源化抗体拥有免疫原性低、亲和力高和半衰期长的特点,因此不容易产生抗药性,而且疗效与稳定性均较好。
ADC药物中的抗体需要:
1、对所选抗原具有高度特异性。若缺乏特异性可能会造成脱靶毒性或被过早清除;
2、与靶向抗原的高亲和力;
3、低免疫原性、低交叉反应活性,从而保证ADC药物在血液中有较长循环时间以及顺利进入肿瘤细胞。
连接子是连接抗体和有效载荷的化学结构,它需要在血液循环中稳定,但在到达靶细胞后能够被有效地切割,释放有效载荷。
连接子包括不可裂解 (non-cleavable) 连接子和可裂解 (cleavable)连接子两种类型。连接子需要考虑稳定性和释放效率的平衡。不可裂解连接子更具稳定性优势,可裂解连接子释放效率更高。连接子不稳定会导致药物游离,导致抗体药物比(DAR降低)。
ADC药物CMC研究包括抗体、载药-连接子中间体、ADC原料药和制剂部分,此外还需要引入一些特殊的质量控制指标。如药物与抗体的比率,载药与抗体的连接位点以及ADC药物中的药物负载分布等。此外,ADC中游离的载药和抗体需要进行量化控制,载药连接抗体后对抗体和靶点结合效力的影响以及ADC在人体血浆中的稳定性也需要进行研究。
筑药网是ADC相关产品定制和服务供应商,拥有R&D实验室和高活性药物生产能力,科研团队拥有专业丰富的化学修饰技术和能力,在库毒素和连接子可以为客户满足从毫克到千克级研发需求,实现从药物研发到临床前CMC生产的全过程服务,降低研发成本,提高药物研发速度和效率。
筑药网可以对高细胞毒的分子设计以糖取代 PEG 为水溶性的连接子(Linker),能快速制备高细胞毒的化合物、双功能团的连接子,实现快速与毒素、抗体连接。
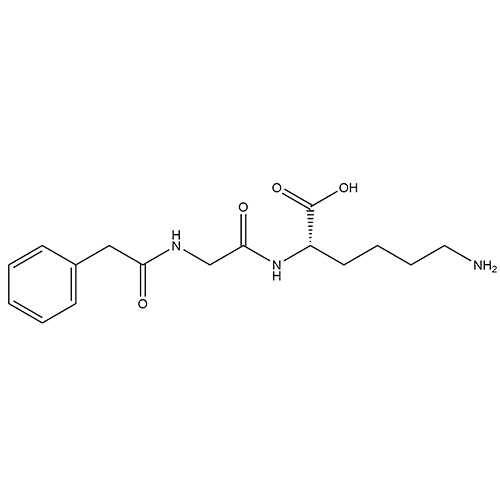
ID : 03543 |
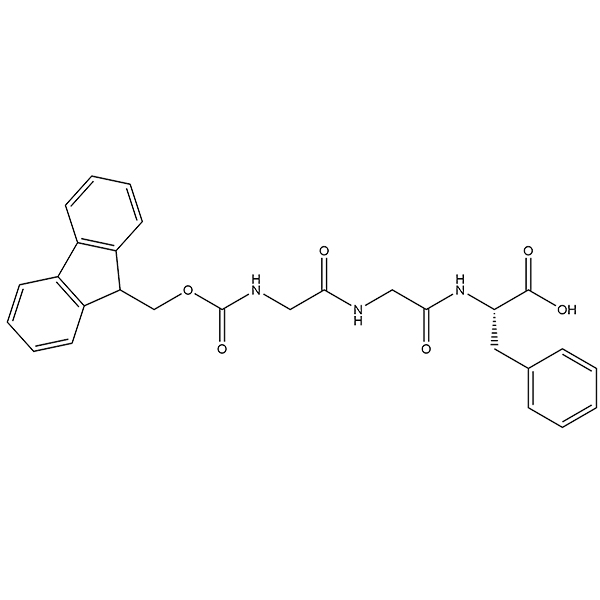
ID : 03542 |
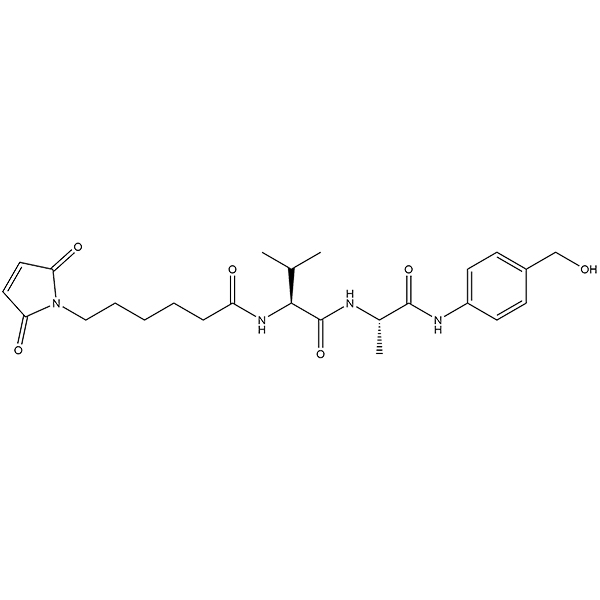
ID : 03541 |
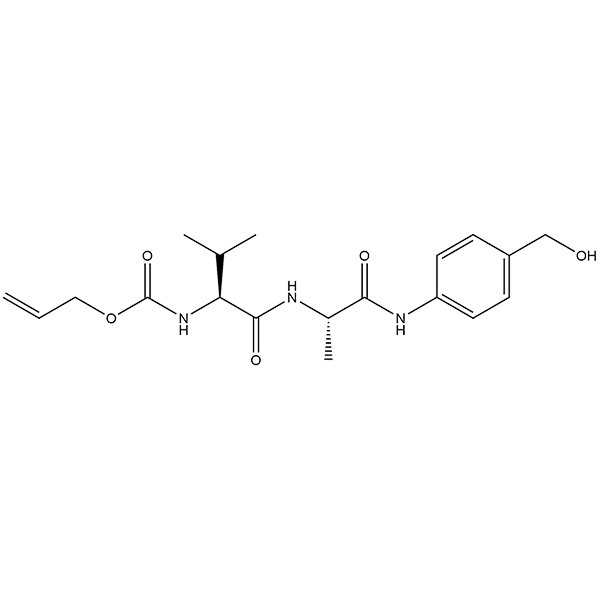
ID : 03540 |
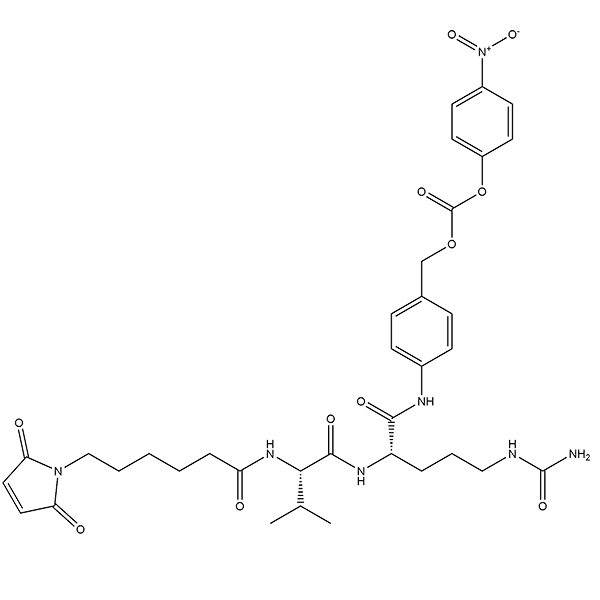
ID : 03539 |
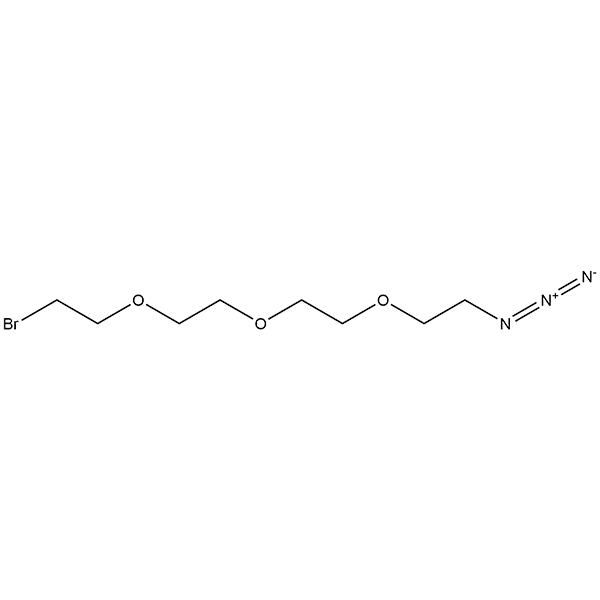
ID : 03537 |
| 更多“ADC Linkers”产品推荐 | |
偶联技术通过连接子将抗体和小分子毒素连接到一起,涉及化学反应、抗体修饰与改造等相关技术。目前,常用的偶联技术可分为随机偶联和定点偶联两大类。传统ADC药物主要采取随机偶联,因此稳定性较差,但第三代新产品已转变为定点偶联,定点偶联技术能让抗体和小分子药物定点,定量偶联,均一性与稳定性较高。
DS-8201采用定点偶联技术,药物抗体比高达8,具有更好疗效。
小分子毒素是ADC药物发挥杀伤活性的主要成分,在选择小分子毒素时需综合考虑毒性、可修饰性等多个因素:
1,与一般化药相比,具有更高毒性;选择旁杀效应较强的毒素,以便毒素更容易扩散到临近细胞(如MMAE及Dxd);
2、可修饰性;
3、适当的亲疏水平衡;
4、高稳定性等。
近年的新产品普遍使用亲水性较强的高效细胞毒性药物,而且亲水性也有所改进,因此杀伤力较强而且比较容易吸收。
细胞毒性载荷是ADCs的“弹头”或“有效载荷”。ADC Payloads通常是有效的抗有丝分裂细胞毒素或DNA 烷化剂或具有其他细胞杀伤机制的试剂。
早期的ADC药物设计旨在携带具有已知抗癌活性的传统化疗药物,例如甲氨蝶呤、多柔比星或长春花生物碱。然而,这些 ADC 并不比它们的小分子细胞毒性药物更有效,有时需要极高的活性剂量,这反而增加了毒性。数据表明,只有很小一部分肿瘤靶向的 mAb 的给药剂量到达肿瘤组织(大约 0.1%),这意味着需要具有更大细胞毒性的有效载荷才能实现治疗效果。对携带高效化疗药物(如澳瑞他汀类、卡奇霉素类、美登素类和喜树碱类似物)的 ADC 进行实验,这些高效化疗药物在亚纳摩尔浓度下可能具有细胞毒性。
ADC药物所采用的偶联技术与其最终的药物抗体比率(Drug to Antibody Ratio;DAR)密切相关。DAR指的是每个抗体分子上连接的有效载荷分子的数量,DAR的数值及其分布会显著影响ADC药物性质。DAR过大可能导致ADC药物聚集,进而在循环系统中被清除;DAR过小,可能导致ADC药物无法达到最佳治疗效果。
DAR的优化对于ADC药物的疗效和安全性至关重要。DAR过低可能导致疗效不足,而DAR过高则可能增加毒性。DAR在2~4之间是ADC药物的最优选。
ADC 作为一种新型靶向的抗癌药物,结合抗体和小分子药物两者优点,拥有巨大的市场前景。随着抗体的发展、连接子不断的优化、高活性载荷的发掘和偶联技术的不断完善,高效低毒的 ADC 药物将会不断涌现。筑药网提供高纯度的ADC药物研发相关中间体,我们的科研团队在库毒素和连接子可以为客户满足从毫克到千克级研发需求;实现从药物研发到临床前CMC生产的全过程服务,降低研发成本,提高药物研发速度和效率。
 沪ICP备2023026221号-1
沪公网安备 31011502400732号
沪ICP备2023026221号-1
沪公网安备 31011502400732号