 400-780-8018
400-780-8018小核酸药物通常由十几到二十几个核苷酸组成,主要分为ASO药和siRNA药两类,通过干预靶向mRNA表达来治疗疾病。与传统的小分子化学药和重组蛋白药相比,小核酸药物具有治疗效果好、特异性强、毒性小、适用范围广等优点。递送系统在小核酸药物研发中扮演着至关重要的角色,它是将小核酸药物安全、有效地运送到靶组织和靶细胞的关键,现在让我们来了解一下小核酸药物的特点、优势以及常见的递送系统有哪些?
小核酸药物的特点包括:
1) 小核酸药物分子是非常不稳定的,易于快速降解。
2) siRNA的分子量约为13kD,ASO的分子量在4~6kD之间,但对细胞摄取来说,分子量仍然过大。
3) siRNA和ASO易被肾脏清除,裸siRNA在血流中的半衰期仅有几分钟。
4) siRNA难以进入细胞内,只有少数细胞如神经元或视网膜神经节细胞能够摄取裸siRNA。siRNA的靶向性仍然具有技术挑战,难以实现靶向到达器官、组织和细胞。
小核酸药物的优势包括:
1) 特异性强,因为小核酸药物是根据目标RNA人工设计的,所以靶点明确且特异性强。
2) 设计简便、研发周期短。临床前研发可以通过基因序列测定,针对疾病基因进行合理设计,避免了盲目开发,节省了研发时间。
3) 靶点丰富,小核酸药物从转录后水平进行治疗,能针对一些蛋白靶点难有疗效的特殊靶点进行突破,有望攻克尚无药物的遗传疾病。
4) 已有成功案例,提高了药物研发的效率和成功率,多款核酸药物已经获批上市,还有更多核酸药物正在临床试验中。
单体及递送系统的修饰是小核酸药物研发的关键,药物递送系统在核酸药物研发中至关重要。
理想的药物递送系统应具备以下特性:
1) 良好的生物相容性,不引起机体的免疫反应;
2) 能够血液中长时间循环,不受核酸酶降解;
3) 较强的靶向性和特异性,能够富集在病灶处;
4) 具备高细胞通透性,便于细胞摄取;
5) 能高效地从内体中逃逸,便于在细胞内发挥作用。
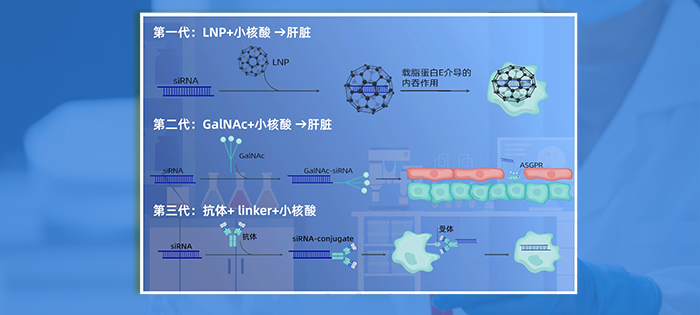
小核酸药物治疗的主要靶器官受到递送系统的影响,而目前针对RNAi给药,好的递送系统是解决挑战的关键。为规避现有专利,开发更有效、更安全的载体系统,各类平台如阳离子脂质体(LNP)、Galnac、exsome、DPC等相继涌现。
筑药网能够高效快捷地提供单体和递送系统的定制和研发服务。目前我们拥有300多个合成砌块,可对单体的核糖、碱基、磷酸骨架进行修饰改造。同时,我们也能对递送系统进行修饰和改造,包括GalNAc和LNP的修饰和改造。
目前递送系统主要有以下几种:
1) LNP(脂质纳米粒):是一种直径约为100 nm的球形载体,由中性辅助脂质、可电离的阳离子脂质、胆固醇和PEG-脂质组成。
2) GalNAc(N-乙酰半乳糖胺)递送系统:主要用于肝靶向。
3) AOC(抗体+ linker +小核酸):将抗体药物的组织特异性与小核酸的靶点特异性相结合,解决了小核酸药物仅能通过LNP和GalNAc递送系统靶向肝脏的问题,具有广阔的发展前景。
在第一代中,LNP和小核酸的组合已被广泛用于肝脏的靶向递送。
脂质纳米颗粒(LNP)目前被广泛用于核酸药物递送中,LNP是一种直径约为100 nm的球形载体,由中性辅助脂质、可电离的阳离子脂质、胆固醇和PEG-脂质组成。
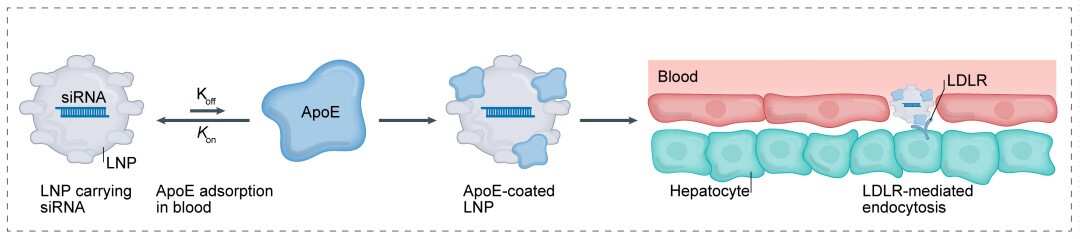
将小核酸药物包裹在脂质纳米颗粒(LNP)中,使被包裹的小核酸药物免于降解和清除,并促进其跨细胞膜运输到目标靶位。LNP携带小核酸药物通过载脂蛋白E(ApoE)介导的内吞作用富集在肝细胞中,适用于治疗肝脏相关的疾病。
LNP递送的mRNA疫苗可以有效克服体内运输障碍,如稳定性差、靶向性弱等。研究表明,使用LNP递送mRNA疫苗的效率是病毒载体的50~100倍。
从治疗领域上看,靶向肝肾等器官的疾病以及肿瘤治疗是LNP主要应用场景,且在肿瘤尤其是肝癌中,LNP相较于其他载体如Galnac也有一定的优势。
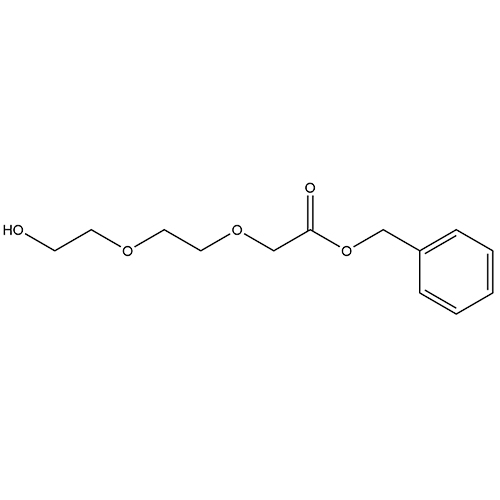
ID : 03286 |
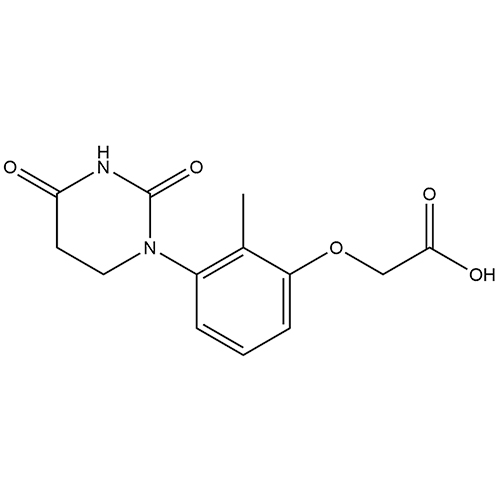
ID : 03585 |
ID : 03255 |
ID : 03254 |
ID : 03252 |
ID : 03250 |
| 备注:筑药网也提供寡核苷酸中间体定制合成服务,能够高效、快捷地提供核苷酸单体、寡核苷酸、寡核苷酸偶联物、递送系统的定制合成和研发。 | |
GalNAc(N-乙酰半乳糖胺)是去唾液酸糖蛋白受体(ASGPR)的配体,去唾液酸糖蛋白受体(ASGPR)是一种在肝细胞的膜表面上高度特异性地表达内吞性受体,而在其他细胞中几乎不表达。ASGPR和网格蛋白介导的内吞作用可以有效地将半乳糖衍生的配体从细胞表面转运至细胞质。
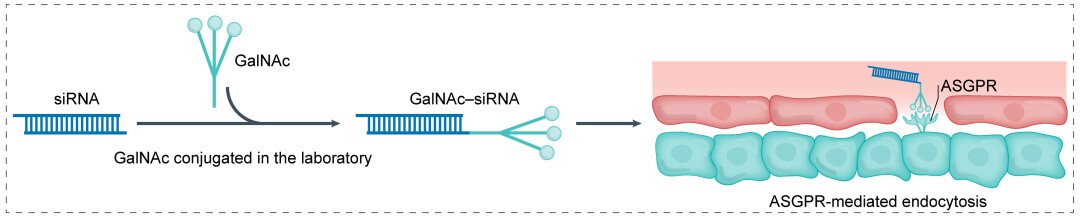
N-乙酰半乳糖胺 (GalNAc) 通过酸敏感的化学linker与小核酸药物相连。酸敏感的linker设计可使核酸偶联物在通过内吞作用进入细胞之后与偶联物脱离。GalNAc能特异性结合肝细胞表面的糖蛋白受体ASGPR,形成的复合物通过胞吞作用进入肝细胞,此外,ASGPR能以较高的循环速率重复使用,并结合胞外其它GalNAc,最终减少给药剂量。ASGPR仅在肝实质细胞中高表达,利用GalNAc递送可精确靶向肝脏,治疗肝部疾病。
提高核酸类药物的靶向性是提高药物递送准确性和治疗效果的关键手段之一,并且能减少药物对非靶细胞的副作用。近年来,GalNAc共轭连接递送技术的开发大大改善了核酸类药物肝脏靶向的递送效果。
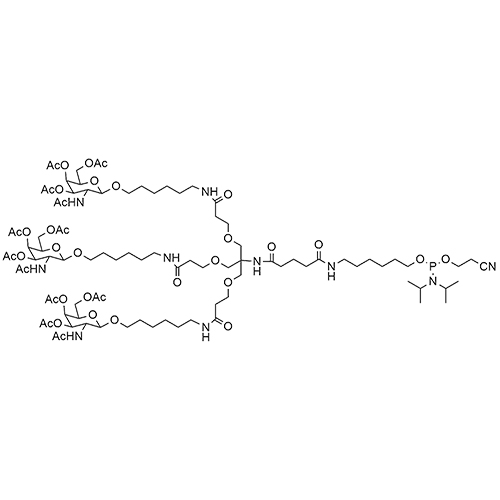
ID : 03247 |
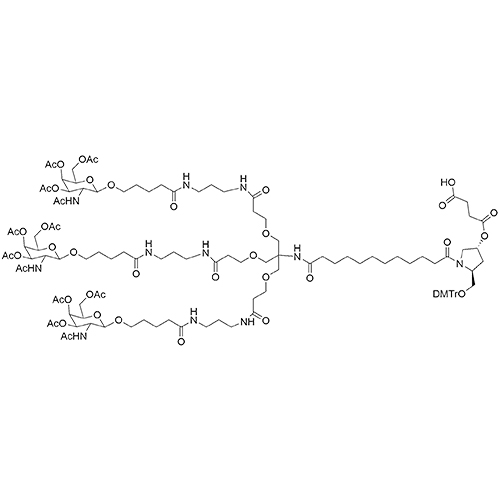
ID : 03246 |
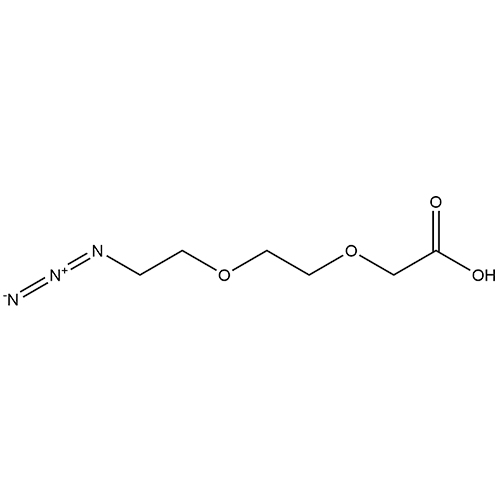
ID : 03545 |
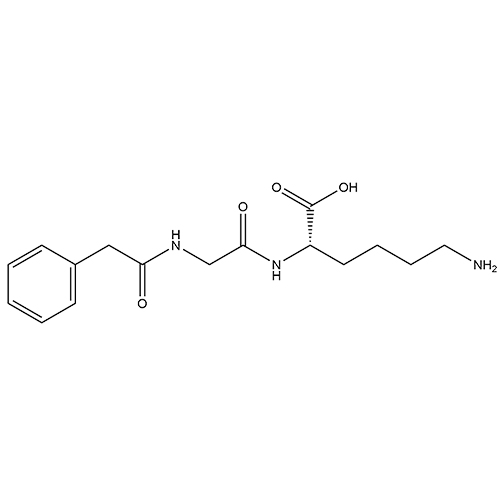
ID : 03543 |

ID : 03240 |
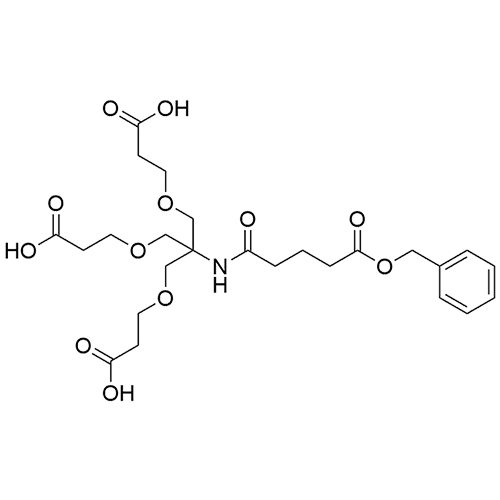
ID : 03239 |
| 更多“GalNAc”分子砌块产品 | |
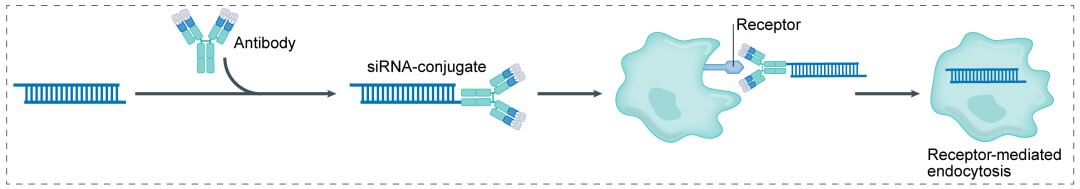
小核酸抗体偶联药物(AOC)的结构与ADC相似,主要由三部分构成:发挥组织靶向作用的载体,连接子(linker),以及作为payload的小核酸。AOC将抗体和小核酸有效地结合在一起,以实现靶向治疗,可以减少治疗疾病所需的药物量,同时解决不可靶向和小核酸药物递送的问题。与传统的小核酸疗法相比,AOC具有更好的药代动力学特性和更具特异性的生物分布。 进一步提高核酸类药物在体内的稳定性、增强递送效率,降低免疫原性,促进核酸药物特定组织细胞精准递送,是未来提高核酸类药物递送的主攻方向。
AOC将抗体药物的组织特异性优势与小核酸的靶点特异性优势相结合,解决目前小核酸药物仅能通过LNP(脂质纳米颗粒)、GalNAc(N-乙酰半乳糖胺)递送系统靶向肝脏的问题,具有靶向性、增加生物利用度、减少毒作用、提高稳定性、增加理想半衰期、提高有效性等优势,因此AOC具备广阔的发展空间。
小核酸药物的适应症范围非常广泛,涵盖了肿瘤、罕见病、病毒性疾病、肾脏疾病、心血管疾病)、炎症类疾病以及代谢类疾病等。随着技术的不断发展和生产工艺的日益成熟,小核酸药物市场将迎来更加广阔的发展空间。目前,核酸药物处于蓬勃发展的阶段,因此对递送系统的深入研究显得尤为重要。
递送系统的设计不仅可以增强药物的稳定性,提高其在体内的生物利用度,还能够减少药物在非靶细胞中的副作用。针对不同的适应症和靶组织,科研人员正在不断开发和优化各种递送系统。这些系统不仅能够提高小核酸药物的靶向性,还可以改善药物的递送效率。
递送系统的不断改进也为小核酸药物的应用提供了更广阔的空间。随着技术的进步,我们可以预见,递送系统将继续成为小核酸药物研发的关键领域之一,为治疗各种疾病提供更加精准、安全、有效的药物递送方案。
 沪ICP备2023026221号-1
沪公网安备 31011502400732号
沪ICP备2023026221号-1
沪公网安备 31011502400732号