 400-780-8018
400-780-8018手性(chirality)是自然界的一个基本特性,通常存在于具有不对称结构的分子中。这些分子被称为手性分子,它们的结构中含有一个或多个手性中心,即与四个不同基团(或原子、电子对)相连的碳、磷或氮等原子。这种结构上的不对称性导致手性分子无法与其镜像重合。当平面偏振光通过这类分子时,偏振光的偏振平面会发生旋转,这种现象表明这些物质具有光学活性。因此,由分子的不对称性引起的异构现象产生的两种结构不同的分子被称为对映异构体(Enantiomer,图1) 。
图1 左右手镜面对称
手性是生命过程的一个基本特征,构成生命体的许多有机分子,特别是含碳的分子,往往是手性的。这些手性分子几乎总是以两种可能的异构体中的一种存在。例如,自然界中的氨基酸存在为L和D两种对映异构体,但在组成蛋白质的α-氨基酸中,几乎全部采用L-型,尽管在一些低级病毒中也发现了D-型氨基酸。在天然糖中,虽然存在D-型和L-型两种构型,但是核糖核酸(RNA)和脱氧核糖核酸(DNA)中的核糖仅采用D-型。蛋白质和核酸主要使用一种类型的手性分子,这一现象被称为分子的手性均一性。
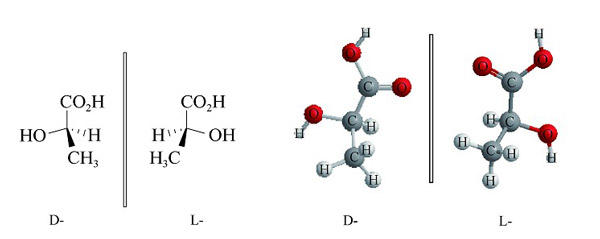
图2 D-型和L-型的乳酸分子结构[2]
自1848年Pasteur成功实现酒石酸钠对映异构体的分离以来,科学家们在手性分子识别、手性化合物和手性药物的合成与分离、手性催化、手性化合物的特殊光电磁性能以及与手性现象相关的生命现象等领域取得了许多重要研究成果。
起初,人们并未充分认识到手性的重要性,认为分子式相同、结构式相似的物质无显著差异。然而,利沙度胺事件的痛苦教训揭示了对映体在生物活性上的差异,对受影响个体而言,这种差异影响深远。
虽然我们知道不同对映体可能具有不同的生物活性,但由于技术限制,目前生产和使用的许多手性化学物质仍是外消旋体。环境中的手性化合物,如苯氧酸类除草剂、有机磷杀虫剂、除虫菊酯类杀虫剂、多氯联苯、邻苯二甲酸盐、氟里昂替代品和DDT衍生物等,因其潜在的生物效应和致癌性、致突变性、致内分泌紊乱性等毒性大多具有对映体选择性,已引起广泛关注。
在21世纪,人们已经认识到手性化合物在医药、农药、食品添加剂、香料、昆虫激素、信息素以及功能材料等方面的重要作用,对手性化合物的需求日益增长。
手性的重要性在医药行业中尤为突出,那么我们如何才能有效地分离出手性化合物的两个对映异构体呢?首先,我们需要找出它们之间的差异。尽管这两个异构体在许多物理性质上非常相似,例如熔点、沸点和溶解度,但我们可以利用它们在旋光性上的差异来进行分离。实际上,通过结晶的方式,我们可以分离出少部分手性化合物。这种方法主要适用于外消旋混合物,因为同构型分子间的相互作用通常大于异构型分子间的相互作用,从而使得同构型分子更容易自组装形成晶体。据估计,这种方法可以处理大约5-10%的外消旋体。
结晶过程并不仅仅依赖于溶解度,而是受到多种因素的影响。在均相体系中,由于成核困难,体系可以维持一段时间的过饱和度,这为优先结晶法(即添加某一构型的晶种以优先析晶)提供了操作空间。这种方法可以有效地分离外消旋混合物,但需要精确控制晶种的添加和结晶条件。
固溶体是另一种情况,由于同异构型间相互作用与同构型间相近,其占比较低(<5%),本篇文章暂不展开讨论。我们的重点在于外消旋化合物,由于同构型分子间相互作用小于异构型分子,同异构型间存在一一对应的关系,填充晶格,构成晶体。这种晶体无法通过简单的析晶操作进行分离,因为它们会同时析出。因此,我们需要创造出它们的区别,类似于双胞胎,我们可以让它们与手性配体形成盐,从而形成非对映异构体,增加它们之间的性质差异,例如,溶解度可能会出现较大差异,便于我们进行分离。这是一种成本较低的化学分离方法,但仅适用于具有成盐位点的化合物,同时需要技巧和运气来选择手性配体和溶剂。当然,还有通过共晶分离的方法,可以克服成盐位点的限制,但难度更大。
超临界流体拆分(SFC)与普通液相类似,固定相由C18等换成了手性物质,也是利用流动相中的待拆分物与固定相的相互作用实现分离,这点又和化学拆分有类似之处。然而SFC的主要局限在于较高的设备和运营成本,以及相对较低的处理通量。尽管如此,在小规模和早期阶段,SFC仍然是一个有效的选择。随着技术的进步和成本的降低,SFC在未来的应用潜力巨大。

在生命科学领域,由于生命体往往偏好特定的分子构型,可以利用这一特性来选择性地消化或保留某一对映异构体。因此,利用酶或细胞进行对映异构体的拆分也是一种有效的方法。
从源头抓起也是一个重要的思路,通过不对称合成或不对称催化,直接合成所需构型,是一个前沿的方向。然而,获得的产品通常仍需要通过结晶、化学拆分等方式进一步提高纯度。下面简要介绍通过结晶纯化的热力学原理。我们通过不对称合成或不对称催化获得的产品是部分富集的,即ee值(对映体过量)大于0。
如果手性物质是以外消旋体形式存在的混合物,其中R和S构型在溶剂中溶解度相同,通过添加溶剂完全溶解含量低的构型(当然,此时含量高的构型也溶解一部分),固相即获得单一构型。通过上清液获得构型的溶解度,绘制三相图(R、S、溶剂的三元相图,下同),如图3所示,可获得理论最佳的溶剂量及收率。
若该手性物质为化合物,同样需要通过上清液获得各构型的溶解度,绘制三相图,以获得理论最佳的溶剂量及收率,如图4所示,但需要分两种情况,1)当起始样品ee值小于共晶ee值,可以采取措施使液相ee值提高到共晶ee值;2)当起始样品ee值大于共晶ee值,可使固相ee值提高到100%。
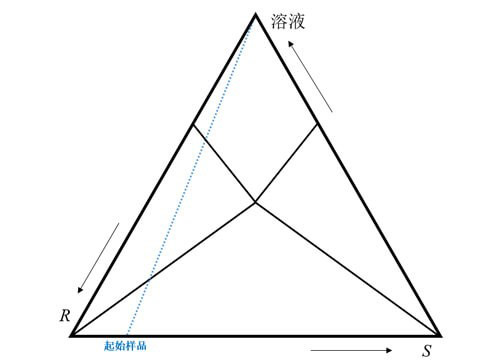
图3 手性混合物三相图
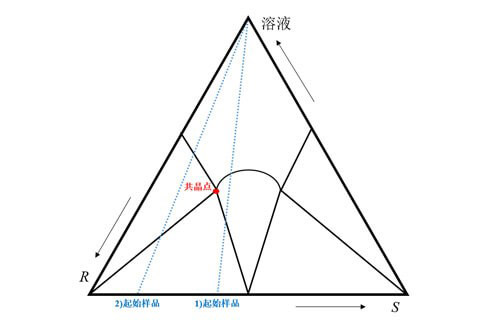
图4 手性混合物三相图
生命的不对称性推动了手性药物研发和应用的增长,而在制药工艺开发过程中,手性拆分往往是关键瓶颈。因此,开发既高效又成本可控的手性拆分技术将显著优化药物开发的流程,实现这一目标需要每位科研工作者的不懈努力。
在手性化合物的研究与开发领域,快速进展的手性合成方法尤为关键,特别是对于那些具有广泛应用价值的重要手性中间体。位于上海的筑药网(Pharmalego)是一家专注于医药中间体销售及定制合成服务的公司。凭借多年的生物医药行业经验、先进的仪器设备以及药物研发的技术优势,筑药网建立了一个集医药中间体研发、生产与销售于一体的电商平台。该平台不仅提供多样化的分子砌块和医药中间体产品,还致力于为客户提供高质量的医药中间体定制合成服务。
[1] 刘维屏,马 云.手性化学污染物的环境行为[J]. 浙江工业大学生物与环境学院
[2] 肖文精,陈加荣.手性起源[J] 华中师范大学化学学院.
[3] 浅谈手性药物的研究策略
[4] J.Jaques, S.H.Wilen, A.Collet; Enantiomers Racemates and Resolution; Wiley-Interscience, New York; 1981, 182.
 沪ICP备2023026221号-1
沪公网安备 31011502400732号
沪ICP备2023026221号-1
沪公网安备 31011502400732号