 400-780-8018
400-780-8018在临床用药中,杂环结构十分常见。这类化合物通常含有氮、氧或硫等杂原子,能够形成氢键并参与电子作用,从而增强与生物靶标的结合能力。杂环化合物是药物化学中的重要组成部分,广泛应用于药物及其他活性分子的合成。
吡嗪(CAS 290-37-9,分子式 C₄H₄N₂,分子量 80.09)是一种含有两个以 1,4-位排列的氮原子的六元芳香杂环。具有生物活性的吡嗪类化合物能够通过多种药物-靶标相互作用发挥药理作用,这为在药物设计中与吩嗪类化合物协同应用提供了理论依据。
吡嗪结构是叶酸中蝶呤部分的重要组成。在工业上,通常以乙醇胺为原料,在气相催化条件下脱氢制得吡嗪。吡嗪具有较弱的芳香性,不易发生亲电取代反应,但易与亲核试剂发生反应。
吡嗪分子中的氮原子具有弱亲核性,可与缺电子的金属化合物反应生成金属配合物,是晶体学和催化剂研究中的重要配体。其氮原子氧化后会改变芳环的电子分布,从而影响化学反应活性。
以吡嗪为结构修饰的天然产物衍生物具有多种生物活性,包括抗炎、抗菌、抗癌、抗寄生虫及抗氧化等。许多衍生物较其母体化合物展现出更高的药理活性和更低的毒性,因此在新药研发中具有重要的研究与应用价值。

结核病(Tuberculosis, TB)由结核分枝杆菌(Mycobacterium tuberculosis, Mtb)引起,尽管目前已有多种抗结核药物,但耐药菌株的持续出现仍使其成为全球性的公共卫生威胁。开发具有新结构特征和作用机制的抗结核药物仍是药物研发的重要方向。
(1)基于吡嗪骨架的新型化合物设计
研究者 Hassan 等人(2020) 设计并合成了一系列以吡嗪为核心骨架、结合多种已知抗分枝杆菌结构片段的杂合分子,共获得 31 种新化合物[1]。 通过 MABA(microplate alamar blue assay) 测定法在体外筛选了这些化合物对结核分枝杆菌 H37Rv 菌株的抗菌活性。结果显示,部分化合物表现出显著抑菌作用,MIC 值 ≤ 6.25 µg/mL,与对照药物吡嗪酰胺的活性相当。
(2)体外安全性与计算机模拟分析
为评估其安全性,研究者采用 MTT 法 对人外周血单个核细胞(PBMC)正常细胞系进行了细胞毒性检测, 结果显示 选择性指数(SI)> 200,表明这些化合物具有较高的安全性。 同时,研究团队还运用多种计算机模拟技术对潜在作用靶点进行了预测,包括基于形状相似性的虚拟筛选、药效团映射及反向分子对接。 多步骤靶点捕捞结果推测,泛酸合成酶可能是这类化合物的重要作用靶点。
(3)分子对接与成药性预测
分子对接结果表明,活性最高的化合物能够稳定结合于泛酸合成酶的活性位点,形成良好的氢键和疏水相互作用。 此外,对其理化性质、药代动力学(ADMET)及类药性进行了计算机模拟预测,结果显示, 化合物 8b、8c 和 8d 兼具高活性与良好安全性,具有作为新型抗结核候选药物的潜力。
因此吡嗪类化合物通过结构优化可显著提升抗分枝杆菌活性,并展现出良好的选择性和成药性,为新型抗结核药物的研发提供了新的思路和候选分子。
多重耐药(MDR)革兰氏阴性菌的快速蔓延,已成为全球公共卫生面临的重大挑战之一。由于传统抗生素疗法的有效性不断下降,亟需开发能够恢复细菌药物敏感性的全新策略。 研究发现,一类含 [1,2,5]恶二唑并[3,4-b]吡嗪 骨架的新型化合物(1)展现出独特的作用机制。该化合物能够选择性地使多种 MDR 革兰氏阴性菌重新对粘菌素(polymyxin)这一“最后防线”抗生素产生敏感性[2]。
在进一步的构效关系(SAR)研究中,研究团队基于化合物 1 的结构,设计并合成了一系列更高效、毒性更低的耐药性修饰剂(Resistance-Modifying Agents, RMA)。这些改良化合物在体外评价中对多种 MDR 菌株均显示出良好的活性,显著增强了粘菌素的抗菌效果。研究结果表明,这类基于吡嗪骨架的 RMA 为应对 MDR 革兰氏阴性菌感染提供了全新的研究方向和药物开发思路。
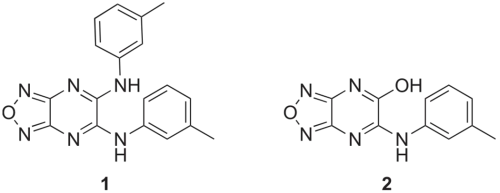
两个RMA结构
近年来,吡嗪类化合物(PYRs)因其广泛的生物活性受到关注。研究表明,部分吡嗪类化合物对幽门螺杆菌(Helicobacter pylori, Hp)具有显著的抑制作用。常韶娜等(2021)通过体外实验发现,PYR-19(2,5-二甲基-3-正戊基吡嗪)能够有效抑制幽门螺杆菌的增殖,并降低其外膜蛋白基因 BabA 及毒力基因 CagA 和 VacA 的转录水平,从而减少相关毒力蛋白的表达[3]。进一步研究显示,经过PYR-19处理的幽门螺杆菌,其诱导胃黏膜上皮细胞(GES-1)分泌炎性细胞因子的能力显著减弱,细胞损伤和凋亡程度也明显降低。这些结果提示,吡嗪类化合物可通过抑制幽门螺杆菌的生长及毒力因子表达,减轻其对胃上皮细胞的损伤,具有潜在的抗幽门螺杆菌药物开发价值。
川芎嗪是一种具有代表性的吡嗪类化合物,因其在心脑血管疾病防治中的潜在作用而受到广泛关注。为提高其抗血小板凝集活性,研究者以不同二胺、2,3-丁二酮和硫辛酸为起始原料,设计并合成了7个川芎嗪衍生物,其结构经¹H NMR、¹³C NMR和ESI-MS确证。采用Born比浊法的体外活性测试结果表明,部分化合物(如化合物1、2和7)对ADP诱导的血小板凝集表现出较强的抑制作用,其IC₅₀值分别为0.26、0.27和0.21 mmol/L,均优于先导化合物川芎嗪(IC₅₀=0.49 mmol/L)[4]。研究结果提示,在不改变川芎嗪核心药效团的前提下,通过环化修饰可显著增强其抗血小板凝集活性,为后续的结构优化与新型抗血小板药物研发提供了重要参考。
吡嗪类化合物在肿瘤治疗领域展现出广泛的生物活性,近年来的研究重点主要集中在免疫调控作用与微管蛋白抑制机制两大方向。
在肿瘤免疫方面,ENPP1(ectonucleotide pyrophosphatase/phosphodiesterase 1)作为cGAS–STING信号通路的负调控因子,可通过水解2′,3′-cGAMP削弱机体的免疫应答。Zhan等(2024)基于结构优化策略,发现了一类高效且选择性的咪唑并[1,2-a]吡嗪衍生物,其中化合物7对ENPP1的抑制活性显著,而对ENPP2和ENPP3作用较弱[5]。该化合物能够增强cGAMP诱导的STING通路下游靶基因(如IFNB1、CXCL10和IL-6)的转录表达。动物实验进一步证实,化合物7具有良好的药代动力学特性,并能显著增强抗PD-1抗体的抗肿瘤疗效,在小鼠模型中表现出超过70%的肿瘤生长抑制率。这表明,咪唑并吡嗪类ENPP1抑制剂可作为肿瘤免疫治疗的潜在增强剂。
在抗微管机制研究方面,Deng等(2022)通过结构融合与环化优化设计了一系列咪唑并[1,2-a]吡嗪衍生物[6]。代表化合物TB-25在多种癌细胞系(HepG-2、HCT-116、A549、MDA-MB-231)中均表现出显著的细胞增殖抑制活性,尤其对HCT-116细胞的IC₅₀为23 nM。机制研究显示,TB-25可有效抑制微管蛋白聚合,导致细胞G₂/M期阻滞和凋亡,并呈浓度依赖性抑制细胞迁移。分子对接结果显示,TB-25可与微管蛋白秋水仙碱结合位点高度契合,与已知微管抑制剂Combretastatin A-4具有良好重叠。这些结果提示,TB-25及相关结构是值得进一步开发的高效微管蛋白抑制剂。
综上,吡嗪类化合物在肿瘤免疫调控与细胞骨架干预两方面均展现出突出的药理潜力,为抗癌药物的结构创新与机制研究提供了重要方向。
吡嗪类化合物具有解热、抗炎、镇痛、抗癌、抗菌及抗氧化等多种药理活性,同时常被用作生物活性分子合成的重要骨架、催化剂以及多种反应体系中的关键结构单元。因此,吡嗪类化合物已成为药物化学与相关领域的研究热点之一。作为一种重要的N-杂环有机化合物,吡嗪类分子在医药及化工领域均展现出广阔的应用前景。
筑药网提供高纯度吡嗪类化合物,助力科研与医药研发。
| 化合物编号 | CAS | 中文名称 | 英文名称 | 分子式 | 分子量 |
|---|---|---|---|---|---|
| 01596 | 1648866-14-1 | 2-(2-乙基-4-(6-甲基吡嗪-2-基)苯基)乙酸甲酯 | methyl 2-(2-ethyl-4-(6-methylpyrazin-2-yl)phenyl)acetate | C16H18N2O2 | 270.3263 |
| 01630 | 2919213-53-7 | N-(3-[(2-氯-5-碘嘧啶-4-基)氨基]甲基吡嗪-2-基)-N-甲基甲磺酰胺 | N-(3-(((2-chloro-5-iodopyrimidin-4-yl)amino)methyl)pyrazin-2-yl)-N-methylmethanesulfonamide | C11H12ClIN6O2S | 454.6745 |
| 03605 | (1-(3-(三氟甲基)吡嗪-2-基)氮杂环丁烷-3-基)氨基甲酸叔丁酯 | tert-butyl (1-(3-(trifluoromethyl)pyrazin-2-yl)azetidin-3-yl)carbamate | C13H17F3N4O2 | 318.2949 | |
| 03794 | N-(5-溴-6-氯-3-(2,4-二氯苯氧基)吡嗪-2-基)-N-[(叔丁氧基)羰基]氨基甲酸叔丁酯 | tert-butyl N-(5-bromo-6-chloro-3-(2,4-dichlorophenoxy)pyrazin-2-yl)-N-[(tert-butoxy)carbonyl]carbamate | C20H21BrCl3N3O5 | 569.6608 | |
| 03797 | 3-苄氧基-6-氯-5-甲基吡嗪-2-羧酸乙酯 | ethyl 3-(benzyloxy)-6-chloro-5-methylpyrazine-2-carboxylate | C15H15ClN2O3 | 306.7442 | |
| 03798 | N-(5-溴-6-氯-3-(2,3-二氯苯基)吡嗪-2-基)-N-[(叔丁氧基)羰基]氨基甲酸叔丁酯 | tert-butyl N-(5-bromo-6-chloro-3-(2,3-dichlorophenyl)pyrazin-2-yl)-N-[(tert-butoxy)carbonyl]carbamate | C20H21BrCl3N3O4 | 553.6614 | |
| 03799 | 141872-22-2 | 3-羟基-5-甲基吡嗪-2-羧酸乙酯 | ethyl 3-hydroxy-5-methylpyrazine-2-carboxylate | C8H10N2O3 | 182.1766 |
| 03800 | 1269026-22-3 | 6-溴-3-羟基-5-甲基吡嗪-2-羧酸乙酯 | ethyl 6-bromo-3-hydroxy-5-methylpyrazine-2-carboxylate | C8H9BrN2O3 | 261.0727 |
| 03801 | 2639780-68-8 | 6-溴-5-甲基-3-[(4-甲基苯磺酰基)氧基]吡嗪-2-羧酸乙酯 | ethyl 6-bromo-5-methyl-3-[(4-methylbenzenesulfonyl)oxy]pyrazine-2-carboxylate | C15H15BrN2O5S | 415.259 |
| 04005 | (E)-4-溴-3-((2-甲基-3-(吡嗪-2-基)烯丙基)氧基)苯甲酸甲酯 | methyl (E)-4-bromo-3-((2-methyl-3-(pyrazin-2-yl)allyl)oxy)benzoate | C16H15BrN2O3 | 363.2059 | |
| 04831 | 925678-00-8 | 6-氯-5-碘吡嗪-2-胺 | 6-chloro-5-iodopyrazin-2-amine | C4H3ClIN3 | 255.4442 |
| 04816 | 173253-42-4 | 5-溴-6-氯吡嗪-2-胺 | 5-bromo-6-chloropyrazin-2-amine | C4H3BrClN3 | 208.4437 |
| 05459 | 566204-90-8 | 5-溴-3-甲氧基-6-甲基吡嗪-2-胺 | 5-bromo-3-methoxy-6-methylpyrazin-2-amine | C6H8BrN3O | 218.0512 |
| 05441 | 259793-88-9 | 6-溴-3-羟基吡嗪-2-甲酰胺 | 6-bromo-3-hydroxypyrazine-2-carboxamide | C5H4BrN3O2 | 218.0082 |
| 05440 | 136866-30-3 | 3,5-二氯-2-碘吡嗪 | 3,5-dichloro-2-iodopyrazine | C4HCl2IN2 | 274.8746 |
| 05389 | 1147998-44-4 | 6-氯-N-(四氢-2H-吡喃-4-基)吡嗪-2-胺 | 6-chloro-N-(tetrahydro-2H-pyran-4-yl)pyrazin-2-amine | C9H12ClN3O | 213.6641 |
| 更多“医药中间体”产品推荐 | |||||
参考文献:
[1] Hassan NW, etc. Novel pyrazine-based anti-tubercular agents: Design, synthesis, biological evaluation and in silico studies. Bioorganic Chemistry, 2020, 96:103610. DOI:10.1016/j.bioorg.2020.103610.
[2] Dutta S, etc. Structure-activity relationship studies of [1,2,5]oxadiazolo[3,4-b]pyrazine-containing polymyxin-selective resistance-modifying agents. Bioorg Med Chem Lett. 2022 Sep 15;72:128878. doi: 10.1016/j.bmcl.2022.128878.
[3]常韶娜,罗强,刘杰,等.吡嗪类化合物抗幽门螺杆菌活性及机制研究[J].中国酿造, 2021.DOI:10.11882/j.issn.0254-5071.2021.02.037.
[4] 樊玲玲, 李毅, 罗碧兰, 等. 吡嗪类化合物的合成及其抗血小板凝集活性测试[J]. 化学通报, 2019, 82(2): 6. DOI: CNKI:SUN:HXTB.0.2019-02-005.
[5] Zhan S, et al. Discovery of Imidazo[1,2-a]pyrazine Derivatives as Potent ENPP1 Inhibitors. J Med Chem. 2024;67(20):18317-18333.
[6] Deng B, et al. Design, synthesis, and bioevaluation of imidazo[1,2-a]pyrazine derivatives as tubulin polymerization inhibitors with potent anticancer activities. Bioorg Med Chem. 2022;76:117098.
 沪ICP备2023026221号-1
沪公网安备 31011502400732号
沪ICP备2023026221号-1
沪公网安备 31011502400732号