 400-780-8018
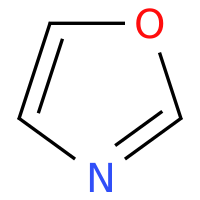
400-780-8018噁唑(Oxazole,CAS号 288-42-6)是一种五元杂环化合物,分子式为 C₃H₃NO,分子量 69.06。由于结构和化学多样性,杂环化合物在抗癌研究和药物研发中具有重要地位。噁唑环的核心结构中含有氧原子和氮原子,分别位于 1 位和 3 位,能够与多种酶和受体结合,从而赋予其潜在的药物活性。
在新型抗癌药物的设计中,噁唑常作为药效核心,与其他功能基团组合以增强活性。噁唑类衍生物,包括噁唑、异噁唑、噁唑啉、噁二唑等,一直是药物研究的热点,相关研究已取得诸多令人关注的成果。
噁唑类五元芳香杂环因其生物电子等排特性以及广泛而重要的生物学活性而备受关注。因此,它们为药物化学中新型骨架的设计与开发提供了理想的预构建平台。噁唑类化合物常作为噻唑、咪唑、苯并咪唑、三唑和四唑等杂环的生物电子等排体,在药物研发中具有重要应用前景。
噁唑类化合物常作为靶向多种受体和酶的配体。在药物化学研究中,它们能够与多种生物靶点结合,展现出抗菌、抗真菌、抗病毒、抗结核、抗癌及抗炎等广泛活性。

在抗癌研究方面,噁唑衍生物通过抑制 STAT3、G 四链体以及微管蛋白等关键靶点,诱导癌细胞凋亡,显示出显著的抗癌潜力。此外,噁唑衍生物还可作用于 DNA 拓扑异构酶、蛋白激酶、Cdc25、线粒体酶、HDAC、LSD1、HPV E2 TAD、NQO1、芳香化酶、BCL-6、雌激素受体、GRP-78 及 Keap-Nrf2 通路等多个靶点。许多衍生物在纳摩尔浓度下即可对多种癌细胞系表现出优异活性,其 IC50 值处于低纳摩尔水平。
1,3-噁唑是一类重要的杂环结构单元,其衍生物表现出广谱药理活性,尤其在抗癌药物开发中具有突出潜力。研究者合成并筛选了一系列新型 1,3-噁唑-4-基三苯基膦盐,在 NCI 平台的体外实验中,部分化合物对多种敏感及耐药癌细胞系显示出显著活性,代表性分子 GI₅₀ 为 0.3–1.1 μM。结构–活性关系分析表明,噁唑环 C(2) 和 C(5) 位引入苯基或 4-甲基苯基是活性增强的关键。值得注意的是,部分化合物与线粒体功能抑制类抗癌药物呈高度相关,提示其可能通过诱导癌细胞凋亡发挥作用。总体来看,1,3-噁唑-4-基膦盐为新型抗癌药物研发提供了有价值的分子骨架,值得进一步深入探索与优化[1] 。
研究者基于已知 B-RAF 抑制剂的结构,设计并合成了一系列含有咪唑并[2,1-b]噁唑骨架的新型 B-RAF 激酶抑制剂。对 22 个最终化合物在 A375 和 SKMEL28 细胞系中进行了细胞毒活性测试,并以索拉非尼作为对照。结果显示,部分化合物的活性均优于索拉非尼。进一步通过 NCI-60 细胞系试验评估了其抗癌活性,其中化合物 11v 和 11u 表现最为突出,在 10 µM 浓度下对 K562 细胞的抑制率分别为 95.99% 和 87.03%。
此外,还测定了部分化合物 和 11v 对野生型 B-RAF、V600E-B-RAF 及 RAF1 的激酶抑制活性。结果显示,化合物 11o 对 V600E-B-RAF 的抑制最强,IC₅₀ 为 34 nM;其次是化合物 11q 和 11u,IC₅₀ 分别为 92 nM 和 93 nM[2]。
研究者合成了一系列以二芳基化合物和芴酮为基础的先导化合物UA-62784 [4-(5-(4-甲氧基苯基)噁唑-2-基)-9H-芴-9-酮]的类似物,旨在增强其对缺失胰腺癌4号位点肿瘤抑制基因(DPC-4,SMAD-4)的人类胰腺癌细胞系的选择性细胞毒性。研究者共合成了超过80种类似物,并评估了其对胰腺癌细胞系的抗肿瘤活性(PC系列)。
尽管这些类似物在结构上与UA-62784——一种已知的有丝分裂驱动蛋白CENP-E抑制剂——具有相关性,但它们均未表现出对DPC-4缺失的胰腺癌细胞系的选择性毒性。此外,这些化合物也未对四种有丝分裂驱动蛋白(包括Kinesin-5、CENP-E、Kinesin-like protein 1 和 mitotic centromere-associated kinesin)表现出强效或选择性抑制作用。因此,研究者进一步评估了其他潜在的作用机制。
在该系列化合物中,二芳基噁唑类先导类似物PC-046 [5-(4-甲氧基苯基)-2-(3-(3-甲氧基苯基)吡啶-4-基)噁唑]被证实可强效抑制多种在人类胰腺癌中过度表达的蛋白激酶,包括酪氨酸受体激酶B(TrkB)、白细胞介素-1受体相关激酶-4(IRAK-4)以及原癌基因Pim-1。暴露于PC-046的细胞在S期出现细胞周期阻滞,随后发生凋亡和坏死。
在动物实验中,与未治疗的对照组相比,PC-046可有效抑制重度联合免疫缺陷(SCID)小鼠中MiaPaca-2肿瘤的生长,肿瘤体积减少约80%。该化合物的血浆半衰期为7.5小时,在小鼠体内可达到超过3 μM的细胞毒性药物浓度。
综上所述,二芳基噁唑类化合物代表了一类新型抗癌药物,其机制可能通过抑制多种与癌症相关的蛋白激酶而发挥抗肿瘤作用,具有良好的开发前景[3]。
T型钙通道是心血管疾病和神经性疼痛治疗中的重要靶点之一。研究者设计并合成了一系列芳基哌嗪基烷基胺取代的噁唑衍生物。这些目标化合物通过便捷的收敛合成法制得,并对其在α(1G) (Ca(V)3.1) T型钙通道上的阻滞活性进行了生物学评估。在合成的41个噁唑衍生物中,部分化合物表现出较强的T型钙通道阻滞活性,其IC50值与阳性对照药米贝拉地尔相当[4]。
通过对噁唑类化合物的药物化学研究,旨在获得结构新颖、活性强、毒性低且药代动力学性质优异,并能对多种疾病展现广谱治疗潜力的候选分子。逐耀网提供高纯度的噁唑类分子砌块产品助力医药研发。
| 化合物编号 | CAS | 中文名称 | 英文名称 | 分子式 | 分子量 |
|---|---|---|---|---|---|
| 03868 | 1256786-78-3 | 2-(2-甲基吡啶-4-基)恶唑-4-羧酸 | 2-(2-methylpyridin-4-yl)oxazole-4-carboxylic acid | C10H8N2O3 | 204.1821 |
| 03169 | 1260836-52-9 | 5-(4-三氟甲基苯基)-1,3-恶唑-2-胺 | 5-(4-(trifluoromethyl)phenyl)-1,3-oxazol-2-amine | C10H7F3N2O | 228.1706 |
| 03184 | 1208129-43-4 | 2-苯磺酰基-5-溴-1,3-恶唑 | 2-(benzenesulfonyl)-5-bromo-1,3-oxazole | C9H6BrNO3S | 288.1178 |
| 03195 | 62124-43-0 | 2-氯-5-苯基-1,3-恶唑 | 2-chloro-5-phenyl-1,3-oxazole | C9H6ClNO | 179.603 |
| 03196 | 135307-33-4 | N,5-二苯基-1,3-恶唑-2-胺 | N,5-diphenyl-1,3-oxazol-2-amine | C15H12N2O | 236.2686 |
| 03871 | 2355832-74-3 | 2-(2-氟吡啶-4-基)恶唑-4-羧酸 | 2-(2-fluoropyridin-4-yl)oxazole-4-carboxylic acid | C9H5FN2O3 | 208.146 |
| 04409 | 93794-45-7 | 5-氯-7-甲基苯并[d]恶唑-2-硫醇 | 5-chloro-7-methylbenzo[d]oxazole-2-thiol | C8H6ClNOS | 199.6573 |
| 04537 | 1642782-80-6 | 5-(4-乙基苯基)-1,3-噁唑 | 5-(4-ethylphenyl)-1,3-oxazole | C11H11NO | 173.2111 |
| 04659 | N-(3-溴苯基)恶唑-2-胺 | N-(3-bromophenyl)oxazol-2-amine | C9H7BrN2O | 239.0687 | |
| 04768 | NA | (R)-4-(4-(甲氧羰基)苯基)-2,2-二甲基噁唑烷-3-羧酸叔丁酯 | tert-butyl (R)-4-(4-(methoxycarbonyl)phenyl)-2,2-dimethyloxazolidine-3-carboxylate | C18H25NO5 | 335.3948 |
| 05302 | 3-(2-甲基-3-((5-(4-(三氟甲基)苯基)恶唑-2-基)氨基)苯基)丙酸乙酯 | ethyl 3-(2-methyl-3-((5-(4-(trifluoromethyl)phenyl)oxazol-2-yl)amino)phenyl)propanoate | C22H21F3N2O3 | 418.409 | |
| 更多“医药中间体”产品推荐 | |||||
参考文献:
[1] Brusnakov M, etal. Evaluation of Anticancer Activity of 1,3-Oxazol-4-ylphosphonium Salts in Vitro. ChemMedChem. 2022 Oct 19;17(20):e202200319. doi: 10.1002/cmdc.202200319.
[2] Abdel-Maksoud MS, etal. Design, synthesis, and anticancer activity of imidazo[2,1-b]oxazole-based RAF kinase inhibitors. Bioorg Chem. 2019 Dec;93:103349. doi: 10.1016/j.bioorg.2019.103349.
[3] Shaw AY, etal. Characterization of novel diaryl oxazole-based compounds as potential agents to treat pancreatic cancer. J Pharmacol Exp Ther. 2009 Nov;331(2):636-47. doi: 10.1124/jpet.109.156406.
[4] Lee JE, etal. Synthesis and biological evaluation of oxazole derivatives as T-type calcium channel blockers. Bioorg Med Chem Lett. 2010 Jul 15;20(14):4219-22. doi: 10.1016/j.bmcl.2010.05.030.
 沪ICP备2023026221号-1
沪公网安备 31011502400732号
沪ICP备2023026221号-1
沪公网安备 31011502400732号