 400-780-8018
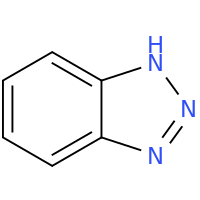
400-780-8018苯并三唑(英文名 Benzotriazole,简称 BTA 或 BA)是一种由苯环与三唑环稠合而成的含氮芳香杂环化合物,分子式 C₆H₅N₃,分子量 119.1。其结构由一个含三个氮原子的五元三唑环与苯环构成,形成稳定的芳香体系。
苯并三唑类化合物在药物化学、有机合成和材料科学中具有广泛应用,是许多药物候选物和功能材料的重要结构单元。该类化合物表现出抗真菌、抗菌、抗增殖、抗癌及抗糖尿病等多种生物学活性,其中三唑环上的氮原子能够与靶点形成氢键,从而增强结合能力。近年来,大量具有活性的苯并三唑衍生物被合成,并证实可与多种酶类靶点结合,发挥相应的药理作用。
咪唑是一类重要的含氮杂环结构,在新型抗癌分子的设计中具有重要应用。由于咪唑环具有富电子特性和独特的构象,它能够与多种生物学靶点(如酶和蛋白质)结合。相关研究显示,部分苯并三唑类化合物也表现出抗癌活性。进一步的分子设计发现,将2,4,5-三芳基咪唑骨架与苯并三唑进行连接能够提升抗癌效果,这一结果表明2,4,5-三芳基咪唑是具有潜力的抗癌药效团。此外,苯并三唑结构中多氮三唑环能够参与氢键作用,有助于增强其与靶蛋白的结合能力。

研究人员合成了一系列由2,4,5-三苯基咪唑(典型三芳基咪唑)连接的苯并三唑衍生物(15a–j),并以阿霉素作为阳性对照,评价其在乳腺癌细胞系 MDA-MB-231 和 MCF-7 中的细胞毒性。所有化合物均通过¹H NMR、¹³C NMR 和 TOF-MS(ES⁺)确认结构。评价结果显示,化合物 15a–j 均具有一定程度的抗癌活性,IC₅₀ 范围为 29–351 μM,其中化合物 15f 活性最强,其 IC₅₀ 为 29 ± 3.2 μM。
进一步的细胞周期与凋亡实验表明,化合物 15f 可诱导细胞在 G1 和 Sub-G1 期积累,并以剂量依赖方式促进细胞凋亡。机制研究显示,15f 能下调 survivin 的表达,同时上调 cleaved PARP、cleaved caspase-3 及 cleaved caspase-9 的水平。此外,分子对接和分子动力学模拟表明,15f 可与 EGFR 蛋白(PDB ID: 4HJO)中的 Thr830 残基形成氢键,且与 EGFR 具有较好的结合亲和力。100 ns 的分子动力学模拟进一步证实了该复合物的稳定性。
总体来看,化合物 15f 在乳腺癌细胞模型中展现出较强的抗癌潜力,但仍需进一步的结构优化与深入研究,以获得活性更优的候选分子[1]。
半胱氨酸生物合成途径为细菌所独有,而人类缺乏该代谢路径,因此该途径中的多种关键酶可作为潜在的抗菌靶点。半胱氨酸在细菌体内参与维持氧化还原稳态,其代谢过程与活性氧相关物质的产生密切相关。当该代谢平衡受到干扰时,会显著影响细菌的适应性及其对抗生素的敏感性。
研究者构建了一个以苯并三唑为核心的衍生物库,这些化合物靶向 O-乙酰丝氨酸巯基酶(OASS),即多数致病菌中负责催化半胱氨酸合成的关键酶。苯并三唑类化合物可作为 OASS 的替代底物,进而竞争性抑制半胱氨酸的生成。
在对三种临床相关革兰氏阴性菌的活性评估中,研究者进一步在体外验证了其中三个最具潜力化合物的作用机制。结果显示,这些分子与已获批准的抗生素联合使用时呈现协同效应。虽然仍需进一步结构优化,但这些化合物有望作为抗生素的辅助药物,用以增强疗效并延缓耐药性的产生[2]。
近年来,基于 1,2,3-苯并三唑结构的新型席夫碱衍生物在 α-葡萄糖苷酶抑制研究中受到关注。已有研究合成了多个此类衍生物(1–18),并通过多种光谱技术对其结构进行了表征。活性评价结果显示,这些化合物整体具有较强的 α-葡萄糖苷酶抑制能力,其中在苯环对位引入羟基的化合物 13 表现出最高活性,其 IC₅₀ 为 2.20 ± 0.30 μM。此外,化合物 3、8、9、10、11、12、14 和 16 的抑制活性亦优于对照药物阿卡波糖。
基于上述活性差异,相关研究建立了构效关系(SAR)模型,指出苯环取代基的性质、数量与空间位置是影响抑制活性的主要因素。分子对接研究进一步揭示了高活性化合物与 α-葡萄糖苷酶活性位点之间的关键相互作用,为理解其作用机制提供了结构基础。
总体来看,苯并三唑类席夫碱衍生物展现出较高的 α-葡萄糖苷酶抑制潜力,其活性普遍优于已报道的同类骨架化合物。构效关系分析与分子对接结果表明,该类分子具有良好的结构可优化性,可为抗糖尿病小分子抑制剂的后续开发提供重要参考[3]。
也有研究者合成了一系列基于苯并三唑的硫脲类似物(1–13),并通过 ¹H NMR、¹³C NMR 和 HREI-MS 等技术对其结构进行了表征,同时评估了其对 α-葡萄糖苷酶和脲酶的抑制活性。结果显示,这些化合物对 α-葡萄糖苷酶的 IC₅₀ 范围为 2.30 ± 0.10 至 19.40 ± 0.20 µM(对照药物阿卡波糖的 IC₅₀ 为 12.30 ± 1.10 µM),对脲酶的 IC₅₀ 范围为 8.50 ± 0.30 至 27.60 ± 0.40 µM(对照硫脲的 IC₅₀ 为 19.20 ± 0.21 µM)。
在两类酶的抑制中,类似物 12 对 α-葡萄糖苷酶的活性最强(IC₅₀ = 2.30 ± 0.10 µM),而类似物 7 对脲酶表现出最高活性(IC₅₀ = 8.50 ± 0.30 µM)。相较之下,类似物 13 在两种酶体系中的抑制能力均最低。
为进一步阐明高活性化合物的作用机制,研究者进行了分子对接分析,验证了其与酶活性位点之间的关键相互作用。此外,所有化合物均在 3T3 小鼠成纤维细胞系上进行了细胞毒性评估,结果表明均无明显毒性[4]。
综合已有研究可以看出,苯并三唑类化合物作为重要的药物先导结构,在酶抑制、抗菌等领域均展现出优异的活性表现。不同取代方式不仅影响其对靶酶的选择性,还能够显著提升抑制效率,为新药研发提供了丰富的结构优化方向。
上海逐耀医药科技公司提供丰富的苯并三唑类分子砌块产品,为小分子创新药的高效研发提供有力支持。
[1] Kumar, Arun et al. “Design and Synthesis of 2-substituted phenyl-4,5-diphenyl imidazole linked benzotriazoles: Anti-breast cancer activity, cell cycle analysis, apoptosis assay, and in silico studies.” Journal of Molecular Structure (2025).
[2] Bova, Stefania et al. “Benzotriazole derivatives as alternate O-acetylserine sulfhydrylase substrates to impair cysteine biosynthesis in gram-negative bacteria” iScience, Volume 28, Issue 11, 113818
[3] Shawkat Hayat et al.” Synthesis, structural characterization, in vitro biological evaluation and in silico molecular docking of some new 1,2,3-Benzotriazole-based Schiff base derivatives“
[4] Qurat ul AinNew et al.” 1,2,3-Benzotriazole-based thiourea analogues: Synthesis, alpha-glucosidase, urease activities and molecular docking study”
 沪ICP备2023026221号-1
沪公网安备 31011502400732号
沪ICP备2023026221号-1
沪公网安备 31011502400732号